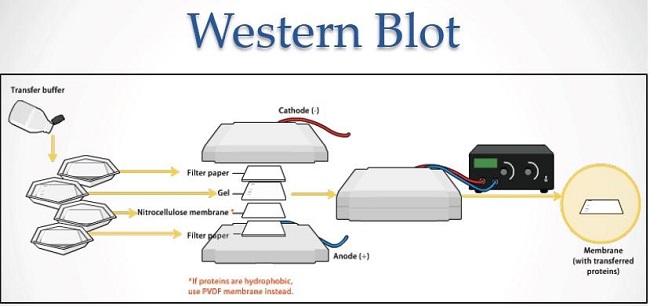
La técnica Western Blot, también conocida como inmunoblot, es un inmunoensayo comúnmente utilizado para identificar, mediante anticuerpos, proteínas previamente separadas por electroforesis.
En este post os traemos una breve guía con consejos para solucionar problemas en Western Blot, en base a las causas más habituales.
Cómo solucionar problemas en Western Blot
Los problemas más frecuente suelen traducirse en alguno o varios de los siguientes aspectos: alto ruido de fondo, señal débil o inexistente, bandas múltiples o difusas, tinción desigual del gel y/o puntos irregulares y desiguales por todo el blot.
A continuación os detallamos las posibles causas (PC) así como los consejos o soluciones (S) para solventarlos:
1.-Alto ruido de fondo:
PC: Concentración de anticuerpo demasiado alta
- S: Optimizar y reducir la concentración de anticuerpo
PC: Formación de agregados del anticuerpo secundario
- S: Filtrar el anticuerpo secundario o utilizar uno nuevo
PC: Temperatura de incubación del anticuerpo demasiado alta
- S: Incubar el anticuerpo a 4ºC
PC: Unión no específica del anticuerpo secundario o reactividad cruzada con el agente bloqueante
- S1: Correr el control del anticuerpo secundario (sin el primario)
- S2: Reducir la concentración del anticuerpo secundario
PC: Reactividad cruzada del anticuerpo primario o secundario con el agente de bloqueo
- S: Añadir Tween-20 a los buffers de incubación y lavado
PC: Agente de bloqueo incompatible
- S: Comparar diferentes buffers de bloqueo
PC: Bloqueo incompleto
- S1: Optimizar la elección del buffer de bloqueo
- S2: Incrementar la concentración de proteína en el buffer de bloqueo
- S3: Optimizar el tiempo y/o la temperatura de bloqueo
- S4: Añadir Tween-20 al agente bloqueante
PC: Bloqueo insuficiente
- S: Ampliar el tiempo de bloqueo o utilizar un agente de bloqueo compatible
PC: Reactividad cruzada del anticuerpo con otras proteínas
- S1: Utilizar diferentes agentes de bloqueo
- S2: Reducir la concentración del anticuerpo secundario
- S3: Analizar la reactividad cruzada entre el anticuerpo secundario y la membrana
PC: Lavado insuficiente
- S1: Incrementar el número de lavados y el volumen del buffer
- S2: Añadir Tween-20 al buffer de lavado
PC: Tiempo de exposición demasiado largo
- S: Reducir el tiempo de exposición
PC: Problemas con la membrana
- S1: Utilizar una nueva membrana
- S2: Asegurarse de que la membrana se mantiene húmeda
- S3: Manipular cuidadosamente evitando dañar la membrana
PC: Membrana incompatible
- S: En general, las membranas de nitrocelulosa suelen dar menor ruido de fondo
PC: Buffer contaminado
- S: Filtrar el buffer o utilizar uno nuevo
2.- Señal débil o inexistente
PC: Transferencia incorrecta de la proteína a la membrana
- S1: Utilizar Ponceau para comprobar la eficiencia de la transferencia
- S2: Asegurar el correcto contacto entre la membrana y el gel durante la transferencia
- S3: Humedecer la membrana según las instrucciones
- S4: Evitar el sobrecalentamiento durante la transferencia
- S5: Utilizar controles positivos o marcadores de peso molecular
- S6: Optimizar el tiempo de transferencia y la corriente
PC: Unión insuficiente entre la proteína y la membrana
- S: Añadir metanol al buffer de transferencia
PC: Anticuerpo insuficiente
- S: Aumentar la concentración de anticuerpo
PC: Antígeno insuficiente
- S: Cargar más proteína
PC: Enmascaramiento del antígeno por el buffer de bloqueo
- S1: Comparar diferentes buffers de bloqueo
- S2: Optimizar la concentración de proteína del buffer de bloqueo
- S3: Reducir el tiempo de bloqueo
PC: Presencia de azida sódica en los buffers
- S: Eliminar la azida sódica de los buffers
PC: Tiempo de exposición demasiado corto
- S: Aumentar el tiempo de exposición
PC: Tiempo de incubación del sustrato demasiado corto
- S: Incrementar el tiempo de incubación
PC: Digestión de la proteína en la membrana
- S: Optimizar la cantidad de agente de bloqueo
PC: Degradación de la proteína durante el almacenamiento
- S: Volver a preparar la muestra con la proteína
PC: Incompatibilidad entre el anticuerpo primario y el secundario
- S1: Asegurarse de la compatibilidad
- S2: Utilizar controles de carga para Western Blot para comprobar la efectividad del anticuerpo secundario (Puedes consultar la guía sobre “Cómo seleccionar controles de carga para western blot” aquí)
PC: Baja concentración del anticuerpo primario y/o secundario
- S1: Incrementar la concentración de anticuerpo
- S2: Aumentar el tiempo de incubación
PC: Reactividad cruzada entre los agentes de bloqueo y los anticuerpos
- S1: Añadir Tween 20
- S2: Cambiar el agente de bloqueo
PC: Incapacidad del anticuerpo primario para reconocer la proteína
- S1: Revisar las instrucciones de uso
- S2: Utilizar controles positivos
PC: No hay suficiente cantidad de proteína
- S1: Aumentar la cantidad de carga en el gel
- S2: Utilizar inhibidores de proteasas
- S3: Utilizar controles positivos
PC: Transferencia insuficiente y lavado excesivo
- S1: Confirmar la transferencia con Ponceau
- S2: Evitar los lavados excesivos
PC: Exceso de bloqueo
- S1: Cambiar el agente de bloqueo
- S2: Reducir el tiempo de bloqueo
PC: Inhibición del anticuerpo secundario por azida sódica
- S: Evitar el uso conjunto de azida sódica con anticuerpo conjugados a HRP
PC: Concentración de metanol demasiado alta
- S: Reducir la concentración de metanol o utilizar alcohol isopropílico
PC: Conjugado inactivo
- S: Mezclar la enzima y el sustrato en un tubo para confirmar que se produce reacción colorimétrica
3.- Bandas múltiples
PC: La proteína de la muestra ha sufrido una digestión
- S1: Asegurarse de que se ha añadido suficiente inhibidor de proteasas en el buffer
- S2: Evitar ciclos de congelación/descongelación de la muestra
PC: Unión inespecífica del anticuerpo primario
- S1: Reducir la concentración de anticuerpo primario
- S2: Reducir la cantidad de proteína cargada en el gel
- S3: Purificar el anticuerpo por afinidad con el antígeno
PC: Demasiada proteína por carril o sistema de detección demasiado sensible
- S: Hacer diluciones seriadas del material de partida
PC: Bloqueo ineficaz
- S: Modificar las condiciones de bloqueo
PC: Concentración de antígeno demasiado baja
- S: Tratar de enriquecer el antígeno por fraccionamiento o inmunoprecipitación
PC: Unión inespecífica del anticuerpo secundario
- S1: Correr un control del anticuerpo secundario, sin el primario
- S2: Seleccionar otro anticuerpo secundario (Puedes consultar la guía para seleccionar los anticuerpos secundarios aquí)
- S3: Ajustar la concentración de anticuerpo
- S4: Aumentar el número de lavados
- S5: Utilizar anticuerpos monoespecíficos
PC: El analito forma agregados
- S1: Aumentar la cantidad de DTT
- S2: Calentar en baño de agua antes de la carga del gel
- S3: Centrifugar brevemente
PC: Contaminación de los reactivos
- S1: Comprobar que los buffers no contengan partículas o contaminación microbiana
- S2: Utilizar nuevos reactivos
4.- Bandas difusas
PC: Exceso de proteína en el gel
- S: Reducir la carga de proteína
5.- Tinción desigual del gel
PC: Contaminación bacteriana
- S: Mantener los anticuerpos a 4ºC y utilizar buffers frescos (puedes consultar la guía sobre “Cómo almacenar los anticuerpos” aquí)
PC: Insuficiente volumen de anticuerpo
- S: Asegurarse de que la membrana está cubierta por el anticuerpo y agitar durante la incubación
6.- Puntos irregulares y desiguales por todo el blot
PC: Contaminación de los reactivos
- S1: Comprobar que los buffers no contienen partículas ni contaminación bacteriana
- S2: Utilizar nuevos reactivos
PC: Insuficiente volumen de solución durante la incubación o el lavado
- S: Asegurarse de que la membrana queda totalmente inmersa durante los lavados e incubaciones con los anticuerpos
PC: Burbujas de aire atrapadas en la membrana
- S: Eliminar las burbujas, especialmente durante la transferencia
PC: Agitación irregular durante la incubación
- S: Asegurar que la agitación es uniforme
PC: Agregación de HRP
- S: Filtrar los conjugados para eliminar los agregados
El Western Blot es una técnica que implica diversos pasos, y no existen unas condiciones óptimas universales que se puedan aplicar a todas las muestras. Es por ello que existen multitud de variables que pueden incidir en que los resultados del ensayos sean los esperados.
Esperamos que estos tips os hayan resultado de utilidad para solucionar problemas en Western Blot. Y si aún tenéis alguna duda, no dudéis en contactar con nosotros.
Entradas relacionadas:
- Cómo validar un anticuerpo monoclonal o policlonal para la transferencia en Western Blot
- Cómo mejorar la precisión del western blot
- Métodos de detección para western blot
- Cómo elegir los anticuerpos para western blot
NEWSLETTER ¡No olvides suscribirte a nuestra newsletter aquí para recibir las actualizaciones semanales de este blog de investigación y anticuerpos!
Fuente imagen: google imágenes (studyblue.com)