Los anticuerpos monoclonales terapéuticos se han convertido en un importante tipo de terapia para diversas enfermedades durante los últimos 25 años.
Como resultado de la pandemia de la COVID-19, se han desarrollado varios anticuerpos neutralizantes del virus SARS-CoV-2. Estos anticuerpos monoclonales se unen al virus y son capaces de «neutralizarlo». Sin embargo, parece ser que la variante ómicron podría comprometer la efectividad de los anticuerpos terapéuticos desarrollados.
En los siguientes párrafos describimos en qué consiste la inmunoterapia pasiva y qué anticuerpos terapéuticos son eficaces para combatir la infección de la variante ómicron.
Inmunoterapia pasiva
La inmunoterapia pasiva se refiere a la infusión de anticuerpos (monoclonales o policlonales) para brindar protección contra infecciones o envenenamientos. Estos anticuerpos pueden ser productos purificados de la sangre de personas inmunes o provenir de animales inmunes no humanos.
La primera terapia que contenía anticuerpos utilizada para tratar enfermedades tuvo lugar en el siglo XIX y hacía frente a la toxina diftérica. El experimento consistió en obtener sangre de animales que ya se habían recuperado de la enfermedad, inactivarla con calor y posteriormente inyectarla en cobayas. Se observó que los animales expuestos a estas preparaciones estaban protegidos cuando se exponían a dosis letales de la bacteria de la difteria o a su toxina. Poco después, los científicos demostraron que podían curar la difteria en un animal inyectándole la sangre de un animal inmunizado.
Desde que se observó que esta estrategia terapéutica funciona también en humanos, la inmunoterapia pasiva se utiliza para tratar a pacientes tras la infección por difteria o citomegalovirus, así como medida preventiva en caso de sospecha de infección por sarampión, tétanos, hepatitis B o el virus de la rabia.
Los anticuerpos monoclonales o policlonales específicos de antígeno que se utilizan hoy en día en inmunoterapias pasivas pueden derivarse de hemoderivados humanos o tener un origen no humano:
- Terapia de plasma de convalecencia: se refiere a la administración de plasma donado por una persona que ha tenido una enfermedad y se ha recuperado de ella. Por ejemplo, personas que han sido previamente infectadas con SARS-COV2 y ahora se han recuperado. Los riesgos de seguridad se minimizan evaluando la presencia de agentes infecciosos en el plasma donado. Además, también se mide el título del anticuerpo y su capacidad de neutralización.
- Ratón humanizado que recibió el antígeno diana: los ratones humanizados se definen como ratones injertados con genes, células o tejidos humanos funcionales. Por ejemplo, a través de la ingeniería genética, algunos ratones se han modificado en sus genes Ig, lo cual permite generar una respuesta de anticuerpos humanos en el ratón. Esta estrategia permite desarrollar anticuerpos terapéuticos completamente humanos y se evitan así los problemas de inmunogenicidad que surgen cuando se utilizan anticuerpos monoclonales que retienen secuencias de ratón. Además, los anticuerpos monoclonales recombinantes tienen menos limitaciones que la terapia de plasma de convalecencia ya que existe un menor riesgo de transmitir enfermedades de la sangre, mayor título de anticuerpos y garantizan una especificidad de epítopo particular.
Anticuerpos monoclonales para el tratamiento de la COVID-19
Si bien las vacunas constituyen la mejor estrategia para combatir la pandemia de la COVID-19, ciertas personas que tienen un alto riesgo de desarrollar síntomas graves podrían beneficiarse de la terapia con anticuerpos monoclonales en caso de contagio. De hecho, los datos de los estudios clínicos sugieren que los anticuerpos monoclonales pueden reducir en gran medida las hospitalizaciones por COVID-19. No obstante, la aparición de ciertas variantes podría conferir resistencia al tratamiento con algunos de dichos anticuerpos monoclonales.
La variante ómicron se detectó por primera vez en Sudáfrica en noviembre de 2021 y se ha extendido rápidamente por muchos países del mundo. Se cree que su mayor transmisibilidad está relacionada con el hecho de que está altamente mutada: con alrededor de 35 mutaciones en la proteína spike (S protein) y al menos 15 mutaciones en el dominio de unión al receptor (RBD domain). Debido a que algunas de estas mutaciones se encuentran localizadas en los epítopos de los anticuerpos neutralizantes, podrían constituir una vía de escape a dichos anticuerpos.
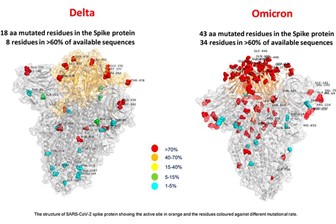
Fuente: l’Ospedale Bambino Gesù, Roma
La proteína S de SARS-CoV-2 juega un papel clave en la infección y patogénesis del virus. Contiene los subdominios S1 y S2, responsables de la unión al receptor de la célula huésped y la fusión con la membrana, respectivamente. En particular, el dominio de unión al receptor (RBD) dentro del subdominio S1, se une a los receptores de la enzima ACE2 (tanto humana como de murciélago) para mediar la entrada del virus en las células. Varios de los anticuerpos terapéuticos desarrollados están dirigidos contra la proteína S. Estos anticuerpos se unen a la región RBD en la proteína S bloqueando así la entrada viral en las células huésped. Además, estos anticuerpos neutralizantes también pueden ejercer su efecto terapéutico activando funciones efectoras mediadas por la región Fc: como la fagocitosis celular dependiente de anticuerpos o la citotoxicidad celular dependiente de anticuerpos.
Hay varios anticuerpos terapéuticos que han sido aprobados por la Food and Drug Administration estadounidense (FDA) y la Agencia Europea de Medicamentos (EMA). Sin embargo, aún se está investigando hasta qué punto estos anticuerpos terapéuticos son eficaces frente a la variante ómicron. A continuación, describimos algunas de las conclusiones obtenidas en las últimas investigaciones.
El anticuerpo terapéutico sotrovimab neutraliza la variante ómicron in vitro
Un estudio reciente, que aún no ha sido revisado por pares, pero está disponible en el servidor de preimpresión MedRxiv (Cameroni et al. 2021), ha evaluado in vitro la capacidad neutralizante contra la variante ómicron de los ocho anticuerpos monoclonales actualmente aprobados para su comercialización. Ninguno de los anticuerpos, con una única excepción, fue eficaz en la neutralización de ómicron. La excepción fue el anticuerpo monoclonal sotrovimab. A pesar de que la actividad neutralizante del anticuerpo sotrovimab fue algo menor que contra las variantes anteriores, seguía presentando actividad neutralizante contra ómicron. En este estudio también se evaluó un panel de 36 anticuerpos monoclonales que se encuentran actualmente en desarrollo, y cuyo epítopo se ha caracterizado estructuralmente. Únicamente cinco de los anticuerpos evaluados (S2K146, S2X324, S2N28, S2X259 y S2H97) retuvieron actividad neutralizante contra la variante ómicron.
Sotrovimab obtuvo la “Autorización de Uso de Emergencia” por parte de la FDA a finales de mayo de 2021, y pertenece a la categoría de los llamados “superanticuerpos”, debido a su amplia capacidad de neutralización de potenciales variantes emergentes. Este anticuerpo, desarrollado por Vir Biotechnology y GlaxoSmithKline, se une a un epítopo en el SARS-CoV-2 que también se encuentra presente en el SARS-CoV-1 (el virus causante del síndrome respiratorio agudo grave o SARS). Es decir, el epítopo contra el que está diseñado está altamente conservado y, por lo tanto, esto dificulta que puedan aparecer mecanismos de resistencia en dicho epítopo. Más concretamente, el epítopo se localiza fuera de la región RBD, a diferencia del resto de los anticuerpos que han sido aprobados, los cuales todos tienen como diana dicha región que se encuentra altamente mutada en ómicron.
Además, el anticuerpo sotrovimab ha sido diseñado con ciertas modificaciones en dos aminoácidos de la región Fc, lo cual aumenta la vida media del anticuerpo y potencialmente mejora su biodisponibilidad en los pulmones. Cabe señalar que, según los datos de los ensayos clínicos, sotrovimab es más eficaz cuando se toma durante las primeras etapas de la infección y está indicado para pacientes con COVID-19 leve a moderado que tienen un alto riesgo de progresión a enfermedad grave. Los mecanismos moleculares por los cuales sotrovimab es eficaz inhibiendo la replicación viral aún están por dilucidar, ya que este anticuerpo monoclonal no compite con la unión al receptor ACE2 presente en las células huésped.
Las investigaciones en curso también están evaluando en qué medida los anticuerpos neutralizantes inducidos por vacunas ofrecen protección contra la variante ómicron. Los datos preliminares sugieren que algunas vacunas ofrecen cierta protección, aunque en menor medida en comparación con las variantes anteriores. Lo más probable es que las dosis de refuerzo sean necesarias para lograr títulos de neutralización efectivos contra ómicron.
Si estas buscando reactivos específicos para investigar la variante ómicron, Abyntek te puede ayudar. Disponemos de una amplia gama de anticuerpos, proteínas y kits ELISA para la investigación del coronavirus ¡contáctanos aquí!
Referencias:
Cameroni, Elisabetta et al. 2021. “Broadly Neutralizing Antibodies Overcome SARS-CoV-2 Omicron Antigenic Shift.” bioRxiv: 2021.12.12.472269. http://biorxiv.org/content/early/2021/12/14/2021.12.12.472269.abstract.
Dolgin, Elie. 2021. “‘Super-Antibodies’ Could Curb COVID-19 and Help Avert Future Pandemics.” Nature biotechnology 39(7): 783–85.
Taylor, Peter C et al. 2021. “Neutralizing Monoclonal Antibodies for Treatment of COVID-19.” Nature reviews. Immunology 21(6): 382–93.