Las proteínas de membrana, embebidas en la bicapa fosfolipídica de la célula, cumplen una función crítica en el mantenimiento de numerosas funciones celulares como la transducción de las señales, el mantenimiento de la integridad celular, el transporte intra y extracelular y la comunicación intercelular, entre otros.
Uno de los requisitos para la realización de estudios estructurales de proteínas de membrana, es la consecución de una fuente abundante de la misma, bien sea una fuente natural o la sobreexpresión heteróloga mediante técnicas de biología molecular. Aunque algunas proteínas de membrana son muy abundantes en determinados tejidos, las de mayor interés, implicadas en la comunicación intercelular y en la regulación de las concentraciones transmembrana de iones y metabolitos, normalmente están presentes en muy bajos niveles, por lo que la expresión heteróloga en estos casos es un procedimiento fundamental, y en muchos casos esta no es una tarea sencilla.
Por otro lado, la obtención de anticuerpos que reconozcan epítopos conformacionales de proteínas de membrana, supone una herramienta de incalculable valor por su capacidad para unirse a las regiones del receptor críticas para el desempeño de una determinada función, así como para detectar proteínas situadas en la superficie celular. El desarrollo de anticuerpos frente a proteínas de membrana como las GPCRs, es extremadamente complicado utilizando estrategias y protocolos tradicionales.
En esta entrada trataremos de daros algunos tips para optimizar la expresión y purificación de proteínas de membrana en sistemas heterólogos, así como la producción de anticuerpos frente a las mismas.
Retos en la expresión recombinante de proteínas de membrana
La expresión de proteínas recombinantes incluye básicamente cuatro pasos: construcción del vector, expresión, purificación y caracterización. Para el caso concreto de las proteínas de membrana, los distintos sistemas de expresión ofrecen las ventajas e inconvenientes que se detallan a continuación:
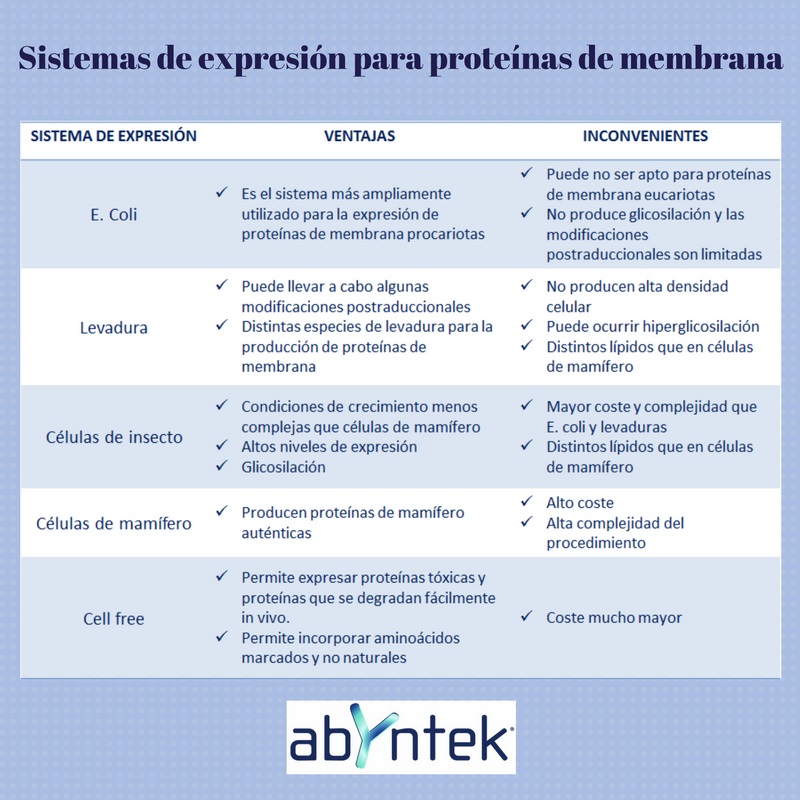
Debido a los requerimientos de las proteínas de membrana de asociarse a membranas celulares, la expresión de las mismas en un sistema heterólogo puede convertirse en un gran reto. A menudo, la expresión recombinante de proteínas de membrana puede dar lugar a la formación de agregados o al mal plegado de la proteína.
La utilización de sistemas de células vivas o preparados de membranas derivadas de células, pueden ayudar a mejorar la estabilidad de las proteínas de membrana, aunque la aplicación de esta técnica tenga sus limitaciones: muy baja concentración de proteína diana, heterogeneidad de los receptores y contaminantes lipídicos, lo que puede resultar en baja sensibilidad y alta variabilidad experimental.
La limitada expresión en la superficie puede deberse a diversos factores: algunas proteínas de membrana se transcriben y traducen en muy bajos niveles debido a incompatibilidad entre los promotores, células o condiciones de crecimiento. Otras proteínas pueden tener limitaciones intrínsecas en cuanto al plegado o el ensamblado de las distintas subunidades, y el intento de sobreexpresión puede sobrepasar la capacidad celular resultando en degradación prematura.
También hay que tener en cuenta que las proteínas de membrana sobre-expresadas pueden resultar tóxicas para las células debido a su función biológica, su actividad o su activación por componentes séricos, y esto puede variar en función del tipo celular y las condiciones de crecimiento.
Tips para optimizar el proceso de expresión de proteínas de membrana:
- La sobreexpresión es el principal cuello de botella durante el proceso de producción de proteínas de membrana recombinantes. Suele resultar de utilidad probar en paralelo la expresión en distintos host y/o cepas para incrementar la probabilidad de éxito.
- En E. coli, los niveles de expresión de proteínas de membrana, incluso en los mejores casos, suelen estar muy por debajo de los niveles de expresión habituales para proteínas solubles.
- Un rango de crecimiento y expresión moderados puede resultar beneficioso a la hora de purificar este tipo de proteínas para evitar la formación de cuerpos de inclusión en E. coli. Para conseguir esto, se puede recurrir al uso de promotores débiles, baja concentración de inductor y a la reducción de la temperatura de crecimiento tras la inducción.
Tips para optimizar el proceso de purificación de proteínas de membrana:
- Conocer al detalle lo descrito en la literatura sobre las propiedades de la proteína diana.
- Realizar experimentos de extracción y solubilización a pequeña escala, con el fin de optimizar los detergentes, la concentración salina, el pH, inhibidores de proteasas, aditivos…
- Reducir al máximo el tiempo de aislamiento.
- Disolver la proteína en el ratio mínimo detergente/proteína.
- Evitar la deslipidación intensiva, que podría afectar a la actividad sin afectar a la estructura.
- Valorar un primer paso de enriquecimiento sin utilizar detergentes.
- Las proteínas de membrana tienden a ser menos solubles a altas fuerzas iónicas, por lo que siempre es recomendable que la concentración de NaCl sea relativamente baja.
- Es frecuente que las proteínas de membrana formen agregados. Se recomienda controlar los factores que puedan inducir o favorecer esta agregación, como el ratio de detergente, el pH…
Retos en la producción de anticuerpos frente a proteínas de membrana
Como decíamos antes, los anticuerpos que reconocen epítopos conformacionales de proteínas de membranas son herramientas muy valiosas por su capacidad de unión a las regiones del receptor críticas para el desempeño de una determinada función, y para detectar proteínas situadas en la superficie celular.
Pero la obtención de este tipo de anticuerpos es un proceso difícil y complejo, principalmente debido a tres factores:
- La mayoría de los epítopos requieren de membranas para configurar su estructura y purificación. Las estrategias para eliminar dichas membranas a menudo desnaturalizan las proteínas destruyendo los epítopos.
- Los epítopos están formados por secuencias cortas y discontinuas, que al no poder plegarse o ensamblase juntas, representan un obstáculo si se pretende utilizar la tecnología tradicional de péptidos o proteínas recombinantes.
- El rendimiento en la expresión de proteínas de membrana suele ser muy bajo, por lo que obtener la suficiente cantidad de material para la inmunización suele ser complicado.
Frente a estas dificultades, existen estrategias novedosas que intentan salvar dichos problemas. Entre las más importantes se encuentran:
- Tecnología de inmunización con DNA (Permite que la producción del antígeno tenga lugar in vivo, evitando la necesidad de expresar y purificar la proteína de membrana in vitro.)
- Opciones alternativas para el diseño de antígenos (DNA, dominio extracelular, péptidos, células…)
- Tecnologías patentadas de modificación antigénica (Diseñadas para romper la tolerancia inmune y producir anticuerpos frente a proteínas con alta homología como las GPCRs)
- Screening de alto rendimiento optimizado (seleccionando directamente los anticuerpos que reconocen el antígeno en la superficie celular en su conformación nativa mediante ELISA de captura, FACS…)
A diferencia de las proteínas solubles, tanto la purificación de proteínas de membrana como la producción de anticuerpos frente a las mismas son procesos complejos que requieren la optimización de múltiples factores que permitan incrementar la probabilidad de éxito de los proyectos. No dudes en consultar con nuestro equipo cualquier duda.
Entradas relacionadas:
- 5 Factores clave en la Producción de Anticuerpos
- Especies para la producción de anticuerpos, ¿cuál es mejor?
- Claves para la producción de anticuerpos policlonales
- Bloqueo de la membrana en Western Blot: ¿BSA o leche?
NEWSLETTER ¡No olvides suscribirte a nuestra newsletter aquí para recibir las actualizaciones semanales de este blog de investigación y anticuerpos!



